عناصر المقال
بحث عن العناصر الممثلة pdf، هو ما سنقدمه لكم في هذا المقال، فكل شيء نراه أو نحس به من حولنا يتكون في النهاية من جزيئات وذرات، سواء من المواد الصلبة أو السوائل أو الغازات أو غيرها، وإن أكثر العناصر الموجودة في الطبيعة تصنف ضمن مجموعة واحدة يطلق عليها، مجموعة العناصر الرئيسية أو التمثيلية، وفي هذا المقال سندرج لكم بحثاً بعنوان بحث عن العناصر الممثلة نتعرف فيه على هذه العناصر وأماكنها في الجدول الدوري، والخصائص المشتركة لهذه العناصر.
مقدمة بحث عن العناصر الممثلة
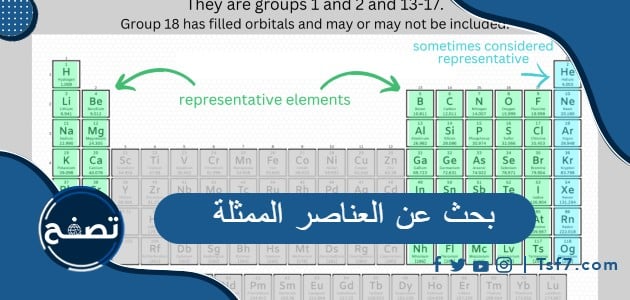
في الكيمياء، يشير مصطلح العناصر التمثيلية إلى العناصر ذات الذرات التي تكون مدارات الإلكترون s وp فيها ممتلئة، ويطلق عليها أيضاً اسم عناصر المجموعة الرئيسية، تشغل هذه العناصر المجموعتين الأولى والثانية والمجموعات من 13 إلى 18 من الجدول الدوري، وتتميز بكونها العناصر الأكثر انتشاراً في الطبيعية، وفي هذا البحث سنسلط الضوء على هذه العناصر ونعرف الخصائص التفصيلية لكل مجموعة من مجموعات العناصر المكونة لها.
بحث عن العناصر الممثلة
وفيما يلي تجدون فقرات هذا البحث عن عناصر المجموعة الرئيسية في الجدول الدوري والتي تسمى بالعناصر الممثلة:
الجدول الدوري
الجدول الدوري، في الكيمياء، هو المصفوفة المنظمة لجميع العناصر الكيميائية حسب زيادة العدد الذري، أي إجمالي عدد البروتونات في النواة الذرية. وعندما يتم ترتيب العناصر الكيميائية على هذا النحو، هناك نمط متكرر يسمى “القانون الدوري” في خواصها، حيث تكون العناصر الموجودة في نفس العمود (المجموعة) لها خصائص متشابهة. كان الاكتشاف الأولي، الذي قام به ديمتري ميندلييف في منتصف القرن التاسع عشر، ذا قيمة لا تقدر بثمن في تطور الكيمياء، ولكن لم يتم الاعتراف فعليًا بأن ترتيب العناصر في النظام الدوري هو ترتيب أعدادها الذرية حتى العقد الثاني من القرن العشرين، والتي تساوي الأعداد الصحيحة من الشحنات الكهربائية الموجبة للنواة الذرية معبرًا عنها بالوحدات الإلكترونية. وفي السنوات اللاحقة تم إحراز تقدم كبير في شرح القانون الدوري من حيث التركيب الإلكتروني للذرات والجزيئات، وقد أدى هذا التوضيح إلى زيادة قيمة القانون، الذي يستخدم اليوم بقدر ما كان عليه في بداية القرن العشرين، عندما عبر عن العلاقة الوحيدة المعروفة بين العناصر.[1]
مفهوم العناصر التمثيلية
في الكيمياء والفيزياء الذرية، المجموعة الرئيسية أو مجموعة العناصر الممثلة هي مجموعة العناصر (تسمى أحيانًا العناصر التمثيلية) التي يتم تمثيل أعضائها الأخف بالهيليوم والليثيوم والبريليوم والبورون والكربون والنيتروجين والأكسجين والفلور حسب ترتيبها في الجدول الدوري للعناصر. تتضمن المجموعة الرئيسية العناصر (باستثناء الهيدروجين، الذي لا يتم تضمينه في بعض الأحيان) في المجموعتين الأولى والثانية من الجدول الدوري (s-block)، وكذلك المجموعات من 13 إلى 18 (p-block) في الجدول الدوري. تتميز عناصر الكتلة s في المقام الأول بحالة أكسدة رئيسية واحدة، وعناصر الكتلة p، عندما يكون لها حالات أكسدة متعددة، غالبًا ما يكون لها حالات أكسدة مشتركة مفصولة بوحدتين.
عناصر المجموعة الرئيسية (مع بعض المعادن الانتقالية الأخف) هي العناصر الأكثر وفرة على الأرض، وفي النظام الشمسي، وفي الكون أيضاً. غالبًا ما تُعد عناصر المجموعة 12 بمثابة معادن انتقالية؛ ومع ذلك، فإن الزنك (Zn)، والكادميوم (Cd)، والزئبق (Hg) يشتركون في بعض خصائص كلا المجموعتين، ويعتقد بعض العلماء أنه ينبغي إدراجهم في المجموعة الرئيسية.
في بعض الأحيان، يتم تضمين عناصر المجموعة 3 بالإضافة إلى اللانثانيدات والأكتينيدات ضمن مجموعة العناصر الممثلة، لأن عناصر المجموعة 3 والعديد من اللانثانيدات بشكل خاص هي عناصر موجبة كهربائيًا مع حالة أكسدة رئيسية واحدة فقط مثل عناصر المجموعة 1 و2. ومع أنّ موضع الأكتينيدات أكثر إثارة للجدل، لكن أكثرها شيوعًا وثباتًا، الثوريوم (Th) واليورانيوم (U)، وهي تشبه عناصر المجموعة الرئيسية حيث أن الثوريوم عنصر موجب كهربائيًا مع حالة أكسدة رئيسية واحدة فقط (+4 ) واليورانيوم له وحدتان رئيسيتان تفصل بينهما وحدتا أكسدة (+4 و+6).[2]
لماذا سميت العناصر الممثلة بهذا الاسم
لقد سميت العناصر الممثلة بهذا الاسم لأنها تقع ضمن متسلسلات العناصر الانتقالية الأساسية، ويطلق عليها أيضًا العناصر النادرة الأرضية، أي لأن التوزيع الذري لها في الغلاف الأخير يمثل رقم المجموعة التي تنمتي إليها الأولى، ويحتوي غلافها الأخير الفرعي على إلكترون واحد، بينما تحتوي المجموعة الثانية على 2 وهكذا، بينما سميت العناصر الانتقالية بهذا الاسم بسبب موقعها في وسط الجدول الدوري ولأنها تظهر سلوكًا انتقاليًا بين عناصر المجموعة سي والمجموعة بي.
مجموعات العناصر الممثلة
- عناصر المجموعة الأولى: الهيدروجين، الليثيوم، الصوديوم، البوتاسيوم، الروبيديوم، السيزيوم، الفرانسيوم، تسمى هذه العناصر مجموعة الفلزات القلوية وتتوضع في العمود رقم 1 من الجدول الدوري، وهي عبارة عن معادن ناعمة ولامعة ومنخفضة الانصهار وعالية التفاعل وتميز بكونها نادرًا ما توجد في شكلها الأولي في الطبيعة، وتحتوي هذه العناصر على إلكترون تكافؤ واحد فقط في مداراتها عالية الطاقة، فهي تكون كمركبات أيونية باستثناء الهيدروجين.
- عناصر المجموعة الثانية: وتشمل كلّاً من البريليوم والمغنيسيوم والكالسيوم والسترونشيوم والباريوم، تسمى هذه العناصر تسمى الفلزات القلوية الأرضية، وتتوضع في العمود رقم 2 من الجدول الدوري، وهي أكثر صلابة وأقل تفاعلًا من الفلزات القلوية، وسبب تسميتها لهذا الاسم هو أن أكاسيد هذه المعادن قامت بإنتاج محاليل أساسية عند إذابتها في الماء، تحتوي ذرات هذه العناصر على إلكترونين في غلافها الفرعي الخارجي، فهي تعتبر شديدة التفاعل بحيث لا يمكن العثور عليها في الطبيعة في شكلها الأولي.
- عناصر المجموعة الثالثة عشر: تتضمن هذه المجموعة كلاً من العناصر البورون والألمنيوم والجاليوم والإنديوم والثاليوم، وتقع في العمود رقم 13 من الجدول الدوري، وتسمى أيضاً مجموعة البورون، تتميز عناصر هذه المجموعة بوجود ثلاثة إلكترونات في أجزاء الغلاف الخارجي لها، وتتفاعل عند درجة حرارة عالية مكونة ثلاثي أكسيد، وعند درجات حرارة عالية تتفاعل الهالوجينات لتكوين ثلاثي هاليدات، كما يتحد البورون مع المعادن لتشكيل البوريدات.
- عناصر المجموعة الرابعة عشر: تتضمن هذه المجموعة كلاً من العناصرالكربون والسيليكون والجيرمانيوم والقصدير والرصاص وتقع في العمود رقم 14 من الجدول الدوري، وتسمى أيضاً مجموعة الكربون، تتميز عناصر هذه المجموعة بوجود4 إلكترونات في الغلاف الخارجي لها، جميع عناصر هذه المجموعة من المعادن إلا أنها تحتوي على عنصر واحد غير معدني وهو الكربون، وفيها واثنين من أشباه الفلزات وهما السيليكون والجرمانيوم، ومعدنين وهما القصدير والرصاص.
- عناصر المجموعة الخامسة عشر: تتضمن هذه المجموعة كلاً من النيتروجين والفسفور والزرنيخ والأنتيمون والبزموث والمسكوفيوم وتقع في العمود رقم 15 من الجدول الدوري، وتسمى أيضاً مجموعة النيتروجين، ومع النزول لأسفل المجموعة يزداد حجم نصف القطر وتزيد نقطة الانصهار والغليان، تتميز عناصر هذه المجموعة بوجود 5 إلكترونات في غلافها الخارجي، وتكون الحالة الطبيعية لجميع هذه العناصر هي الحالة الصلبة في درجة حرارة الغرفة باستثناء النيتروجين.
- عناصر المجموعة السادسة عشر: تتضمن هذه المجموعة كلاً من الأكسجين والكبريت والسيلينيوم والتيلوريوم والبولونيوم وتقع في العمود رقم 16 من الجدول الدوري، وتسمى أيضاً مجموعة الأكسجين، تتواجد هذه العناصر بشكل كبير في الطبيعة فهي ترتبط ارتباطًا وثيقًا بالحياة، ومع الانتقال من الأكسجين إلى البولونيوم يزداد نصف القطر الذري والأيوني، ويزداد الحجم الذري من الأكسجين إلى التيلوريوم، بالإضافة إلى ازدياد نقاط الانصهار والغليان.
- عناصر المجموعة السابعة عشر: تتضمن هذه المجموعة كلاً من الفلور والكلور والبروم واليود والأستاتين والتينيسين وتقع في العمود رقم 17 من الجدول الدوري، وتسمى أيضاً مجموعة الهالوجينات، وهي المجموعة قبل الأخيرة ويليها فوراً مجموعة الغازات النبيلة، وتحتوي على العناصر المعدنية السامة، تتميز عناصر هذه المجموعة بأن لديها بعة إلكترونات تكافؤ في غلافها الخارجي، وبالتالي فإنها تحتاج إلى إلكترون إضافي واحد فقط لتكوين ثماني إلكترونات لتصبح أكثر تفاعلًا من المجموعات غير المعدنية الأخرى.
- عناصر المجموعة الثامنة عشر: تتضمن هذه المجموعة كلاً من الهيليوم والنيون والأرجون والكريبتون والزينون والرادون وتقع في العمود رقم 18 من الجدول الدوري، وتسمى أيضاً مجموعة الغازات النبيلة، وهي المجموعة الأخيرة وتقع في العمود الأخير من الجدول الدوري، ويتم ترتيب عناصر هذه المجموعة وفقًا لدرجة غليانها، ويعد الرادون عنصراً شديد النشاط الإشعاعي ولا يتم استخدامه إلا بكميات دقيقة في العلاج الإشعاعي، ويتم استخدام الزينون كمخدر بسبب قابليته العالية للذوبان في الدهون، وأكثر ما يميز هذه المجموعة من العناصر أن الغلاف الخارجي لإلكترونات التكافؤ مشبع ويحتوي على 8 إلكترونات تكافؤ، ومن الخصائص الأخرى التي تتمتع بها هذه المجموعة أنها غازات عديمة اللون والرائحة والطعم وهي غير قابلة للاشتعال.[1]
تصنيف العناصر الممثلة
تشير القياسات الكيميائية إلى أن استخدام PCA وHCA (وهي من الطرق المستخدمة لتحليل العناصر) لتصنيف جميع العناصر التمثيلية إلى معادن وغير معادن بناءً على نصف القطر الذري، وطاقة التأين الأولى، وتقارب الإلكترون، والسالبية الكهربية لا يمكن أن يكون دقيقاً، حيث توصف أشباه الفلزات بأنها عناصر ذات خصائص دورية تقع في مكان ما بين المعادن واللافلزات. ونتيجة لذلك، يجب أن تتصرف أشباه الفلزات بشكل مشابه لهاتين المجموعتين من الجزيئات بطرق مختلفة. المبدأ التوجيهي الرئيسي لتمييز المعدن عن غير المعدن، وفقًا لـ PCA، هو أن المعادن لها نصف قطر ذري أكبر ولكنها أقل طاقة تأين، وألفة إلكترونية، وسالبية كهربية، في حين أن غير المعادن لها عكس ذلك، كما أن بعض الجوانب لديها الكثير من أوجه التشابه مع العناصر الأخرى. ويرجع ذلك إلى حقيقة أن كلاهما لهما صفات دورية متشابهة. ومع ذلك، من المهم أن نأخذ في الاعتبار أنه عندما تؤخذ الصفات الأخرى مثل نقطة الغليان، ونقطة الانصهار، والكثافة، والموصلية في الاعتبار، فإن سلوك العناصر التمثيلية التي تم فحصها باستخدام PCA وHCA يمكن أن يتغير بشكل كبير.[3]
خاتمة بحث عن العناصر الممثلة
إذاً فالعناصر الممثلة هي العناصر ذات الذرات التي تكون مدارات الإلكترون s وp فيها ممتلئة في المجموعتين الأولى والثانية من الجدول الدوري (s-block)، وكذلك المجموعات من 13 إلى 18 (p-block) في الجدول الدوري، ويتم تصنيف هذه العناصر إلى معادن وغير معادن بناءً على نصف القطر الذري، وطاقة التأين الأولى، وتقارب الإلكترون، والسالبية الكهربية حيث أن العناصر المعدنية لها نصف قطر ذري أكبر ولكنها أقل طاقة تأين، وألفة إلكترونية، وسالبية كهربية.
بحث عن العناصر الممثلة doc
تعد العناصر الممثلة من المفاهيم الأساسية في مادة الكيمياء، ويتم تدريس هذه المفاهيم في المناهج الرسمية في المدارس والجامعات حول العالم، ونظراً لأهمية هذا الموضوع فقد آثرنا أن نترك لكم هذا البحث عن عناصر المجموعة الرئيسية بصيغة doc يمكنكم تحميله “من هنا“.
بحث عن العناصر الممثلة pdf
وللذين يرغبون بطباعة هذا البحث ونشره ومشاركته مع أصدقائهم أو الاحتفاظ بنسخة إلكترونية منه فإن الصيغة النسب لهذا الأمر هي صيغة pdf ويمكنكم الحصول على هذا البحث بهذه الصيغة من خلال النقر ” من هنا“.
مقالات قد تهمك
| بحث عن العوامل المؤثرة في سرعة التفاعل الكيميائي | بحث عن نماذج الذرة كامل بالمقدمة والخاتمة |
| بحث عن تغيرات الحالة الفيزيائية جاهز للطباعة |
إلى هنا نكون قد وصلنا وإياكم إلى نهاية مقالنا الذي قدمناه لكم بعنوان بحث عن العناصر الممثلة pdf والذي تحدثنا فيه عن الجدول الدوري ومفهوم العناصر التمثيلية وبينا لكم مجموعات العناصر الممثلة وخصائصها وكيفية تصنيف العناصر الممثلة.
المراجع
- ^ britannica.com، periodic table، 27/12/2024
- ^ en.wikipedia.org، Main-group element، 27/12/2024
- ^ unacademy.com، The Representative Elements On The Modern Periodic Table، 27/12/2024

التعليقات